Electroforeza
proteinelor pe hartie de filtru
Principiul
metodei
O proba de material biologic (ser) care contine proteine este
depusa pe o banda de hartie de filtru speciala. Sub
influenta curentului electric aplicat la capetele acestei benzi imbibate
in solutie tampon cu pH = 8,6, particulele de proteine plasmatice
incarcate negativ se deplaseaza spre anod (+) cu viteze de migrare
diferite, specifice fiecarei fractiuni proteice, separandu-se. In
prezenta unui colorant proteinofil fractiunile separate se
evidentiaza sub forma de benzi cu pozitii decalate
datorita mobilitatii electroforetice diferite pe care la
poseda. Imaginea obtinuta dupa separare si colorare
poarta denumirea de electroforegrama. Evaluarea
fractiunilor proteice separate se face dupa intensitatea culorii
obtinute prin procedeul elutiei sau direct.
Materiale
necesare
1. Aparatul de
electroforeza
a. Sursa de curent
este alcatuita dintr-un redresor care
furnizeaza curent continuu prin stabilizarea curentului de la retea.
Redresorul debiteaza o tensiune reglabila intre 0 - 500 volti
si o intensitate maxima a curentului de 50 mA. Redresorul este
prevazut cu un voltmetru si cu un miliampermetru necesare
ajustarii si stabilizarii exacte a parametrilor care definesc
campul electric pentru efectuarea electroforezei (120 sau 200 V).
b. Cuva de electroforeza
alcatuita din:
cutie de material plastic cu doua compartimente pentru electrozi, ce
comunica intre ele, unul pentru anod si celalalt pentru catod,
in care se introduce solutia tampon de pH si tarie ionica
cunoscute;
electrozi de carbune sau de sarma de
platina spiralata, care sunt dispusi in fiecare compartiment;
suport detasabil care permite fixarea in pozitie orizontala a
benzilor de hartie de filtru pe care se realizeaza fractionarea
proteinelor;
capac care
inchide etans cuva de electroforeza si prin care se poate
urmari procesul de migrare electroforetica;
2. Suportul
de migrare este reprezentat de o hartie de filtru speciala tip Whatman
nr.1, 4 sau 100, taiata sub forma de benzi, cu
dimensiunile de 3/30 cm. Hartia de filtru trebuie sa prezinte
urmatoarele caracteristici:
structura
omogena si grosime uniforma pe toata suprafata;
suprafata
neteda si curata;
nu adsoarbe proteine;
absorbtie
minima si egala pentru toate fractiunile proteice.
3. Reactivii
a. Solutie tampon:
acid dietilbarbituric(barbital) 1,84 g
sarea de sodiu a acidului dietilbartituric
(dietilbarbiturat) 10,30 g
Se aduce la un litru cu apa distilata.
Caracteristici:
buna
conducatoare de electricitate
pH constant = 8,6 >
pHi
pH = 8,6 > pHi la care toate fractiunile
proteice sunt incarcate negativ (anioni) si migreaza spre polul
pozitiv (pHi = 4,9 pentru albumine, pHi = 6,5 pentru γ-globuline)
b. Solutia de colorare:
albastru de bromfenol 0,01 g
sulfat de zinc 5 g
acid acetic glacial 5 ml
Se aduce cu apa distilata la 100 ml.
Caracteristici:
se fixeaza pe toate
proteinele de pe suportul de migrare in cantitati direct
proportionale cu cantitatile fractiunilor proteice.
c. Solutia de spalare:
acid acetic 5%
Solutia de spalare
indeparteaza colorantul de pe hartia de filtru, astfel incat
raman colorate numai fractiunile proteice.
d. Solutia
de etalare (eluanta):
carbonat de sodiu cristalizat 10%.
Solutia de carbonat de sodiu se
amesteca in volume egale cu metanol (metanolul se adauga in
cantitati mici, cu agitarea recipientului, pentru a evita
precipitarea).
Solutia eluanta dizolva
colorantul fixat pe proteine, care trece de pe fractiunea proteica
fixata pe hartia de filtru in solutia eluanta. Aceasta se va
colora cu atat mai intens cu cat fractiunea proteica a fost mai
colorata (direct proportional cu cantitatea de proteina din
fractiunea respectiva).
4.
Dispozitiv automat sau fotometru pentru evaluarea cantitativa:
Fractiunile proteice separate se pot evalua
cantitativ prin doua procedee:
prin fotometrare directa a electroforegramei,
utilizand un densitometru (intregrator) automat si obtinerea curbei
respective din care se calculeaza procentul fiecarei fractiuni
proteice separate;
prin decuparea spoturilor colorate, elutia lor si determinarea extinctiei la fotometru.
5. Alte materiale necesare:
stativ cu eprubete
micropipete
foarfece
bai de colorare
bai de spalare
vase cu solutie
dezinfectanta
apa distilata
tifon
Proba
Ser
Tehnica de lucru:
a. Aplicarea probei
Pe benzile de hartie de filtru speciala, cu
dimensiunile mentionate anterior, se marcheaza transversal linia de
start, cu creionul, la 8 cm distanta de unul din capetele benzii.
Linia de start reprezinta pozitia de aplicare a probei supuse
analizei.
Se umecteaza benzile de hartie de filtru in
solutia tampon cu pH = 8,6 si se elimina excesul de lichid prin
tamponarea lor cu hartie de filtru obisnuita.
Se asaza cuva pentru
electroforeza in pozitie orizontala pe o masa.
Se toarna solutie tampon in cele
doua compartimente ale electrozilor (acestea comunica intre ele,
astfel incat prin inclinarea usoara a cuvei lichidul ajunge la
acelasi nivel in ambele compartimente)
Se intind benzile in pozitie perfect
orizontala pe suportul amplasat in cuva de electroforeza, astfel
incat capetele acestora sa fie imersate in solutia tampon din cele
doua compartimente ale cuvei.
Capatul benzilor prevazut cu linia de
start se asaza spre catod, deoarece directia de migrare a
fractiunilor proteice va fi spre anod (pH-ul tamponului fiind in domeniu
alcalin, proteinele se vor incarca electronegativ).
Se lasa benzile sub tensiunea curentulului
electric timp de 15 minute, pentru echilibrare.
Se aplica cu ajutorul unei micropipete 10 l
din proba de ser. Aplicarea probei se face prin miscari liniare
repetate ale varfului pipetei de-a lungul liniei de start (se evita
aplicarea probei pana la marginile benzii).
b. Migrarea
Se asigura etanseizarea cuvei de
migrare cu ajutorul capacului, se pune in functiune redresorul si se
stabilesc parametrii curentului electric (tensiunea si intensitatea).
Tensiunea (diferenta de potential) se
calculeaza prin raportare la lungimea benzii de hartie, iar intensitatea
curentului prin raportare la latimea benzilor de hartie. In general
se recomanda ca tensiunea sa nu depaseasca 10 V/cm,
iar intensitatea 2,5 mA/cm.
Dupa terminarea timpului de migrare
(migrare rapida 4 - 6 ore sau
migrare lenta 18 ore) se intrerupe curentul si se scoate din
cuva suportul cu benzile de hartie.
Benzile de hartie se usuca la temperatura
camerei timp de 30 de minute, apoi se
introduc in etuva la 110°C timp de 15 minute pentru fixarea proteinelor
separate.
c. Colorarea
Benzile de hartie de filtru se imerseaza
intr-o baie de colorare care contine solutia de albastru de bromfenol
cu care se lasa in contact timp de cel putin 30 de minute.
Dupa acest interval de timp benzile se
introduc in baia care contine
solutia de spalare si se repeta de cateva ori operatia
de spalare, pana ce fondul hartiei devine incolor. Prin
indepartarea excesului de colorant neretinut de fractiunile
proteice, acestea apar individualizate sub forma de benzi colorate in
albastru.
Ulterior, benzile de hartie de filtru pe care
sunt etalate fractiunile proteice se usuca la temperatura
ambianta, iar dupa uscare se trec prin vapori de amoniac care
schimba culoarea indicatorului, fractiunile proteice separate
devenind albastru - violet.
d. Evaluarea cantitativa a
electroforegramelor:
Electroforegrama
obtinuta prin separarea proteinelor serice se compune din cinci
fractiuni proteice, sub forma de benzi, carora li se
masoara densitatea optica, fiecare banda avand un maxim de
absorbtie.
In ordinea mobilitatii
electroforetice (exprimata ca diferenta in centimetri de la linia de
start pana la mijlocul fiecarei fractiuni separate),
fractiunile sunt: albumina, α1, α2,
β si γ- globuline.
Albumina este
fractiunea cu cea mai mare mobilitate electroforetica, fractiunile
α si β poseda mobilitate electroforetica
intermediara, iar globulinele, mobilitatea cea mai mica. Albumina,
α1 si β globulinele apar sub forma unor benzi
omogene, bine definite, α2 si γ globulinele apar ca
benzi difuze, iar fractiunea γ prezinta in partea sa
centrala o zona mai intens colorata.
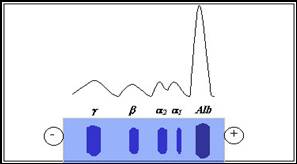
Figura 49 Aspectul
benzilor fractiunilor proteice separate
electroforetic
insotite de electroforegrama normala
Se pregatesc cinci eprubete in care se
pipeteaza cate 5 ml de solutie eluanta.
Se traseaza cu creionul pe
electroforegrama conturul fiecarei fractiuni colorate.
Se decupeaza cu foarfeca fiecare
fractiune, taind suprafata respectiva de hartie de filtru
in portiuni mici.
Portiunile de hartie corespunzatoare
fiecarei fractiuni se introduc separat in cele cinci eprubete pentru
eluarea colorantului retinut de fractiunea respectiva.
Se astupa eprubetele si se lasa
30 de minute pentru eluarea colorantului, timp in care eprubetele se agita
de cateva ori.
Dupa omogenizare se determina la
fotometru, la lungimea de unda de 570 nm, in cuve de 1 cm extinctia
lichidului colorat obtinut dupa eluare.
Se obtin pentru fiecare banda cinci
valori de densitate optica proportionale cu concentratiile
proteinelor din zonele respective (albumine, α1, α2,
β si γ- globuline).
Se calculeaza totalul acestor valori care
se considera 100%.
Se calculeaza valorile procentuale ale
fiecarei fractiuni proteice separate electroforetic, dupa
urmatoarea formula:
x = E
unde:
x = valoarea procentuala a fiecareia dintre cele cinci
fractiuni proteice separate
E = extinctia
determinata a fractiunii x
= suma
extinctiilor celor cinci fractiuni (considerata 100 %)
Pentru a exprima fractiunile in g/100 ml
ser, se determina valoarea proteinelor totale si se calculeaza
cantitatile corespunzatoare fiecarei fractiuni pe baza
concentratiilor procentuale obtinute.
Raportul
albumina/globuline (A/G) se calculeaza prin relatia:
A/G
= E albumina / Σ E globuline


