METODE DE ANALIZA SPECTRALA
SPECTROFOTOMETRIA DE ABSORBTIE
Metodele optice de
analiza constituie in prezent mijloacele cele mai mult utilizate in
analiza chimica. Aceste metode folosesc radiatiile de toate lungimile
de unda care la trecerea lor printr-o substanta provoaca
fenomene de absorbtie, emisie, difuzie, etc. care se pot masura cu
aparate specifice.
Fenomenele care au loc la nivelul electronilor
din legaturile chimice ale moleculelor (proprietati moleculare) constituie fenomene de absorbtie
a luminii in ultraviolet (185 - 400 nm), vizibil (400 - 800 nm) si infrarosu (peste 800 nm), iar fenomenele
care au loc la nivelul electronilor, atomilor (proprietati atomice)
se intilnesc in emisia, absorbtia, fluorescenta, etc.
Spectrofotometria de
absorbtie cuprinde acele metode de analiza care au la baza
modificarea intensitatii unei radiatii
electromagnetice trecute printr-o solutie. Aceasta modificare se
datoreaza absorbtiei unei anumite cantitati din energia
radiatiei, la o anumita lungime de unda, de catre
solutia de cercetat.
Determinarile
spectrofotometrice in UV si vizibil se bazeaza pe masurarea
intensitatii luminii absorbite, care are loc dupa legea
Bouguer-Lambert-Beer si care stabileste relatia dintre lumina
absorbita, structura si concentratia solutiei, grosimea
stratului absorbant, pentru o anumita lungime de unda (A., nm).
|
|
l = intensitatea luminii transmise;
I0 = intensitatea luminii incidente
e = constanta, depinde de structura
substantei;
c =
concentratia (%,g/l);
l = grosimea
stratului absorbant (cm).
|
Extinctia (E) sau
absorbanta, sau densitatea optica este logaritmul zecimal al raportului
dintre intensitatea luminii incidente (I0)
si intensitatea luminii transmise (l) si este proportionala
cu concentratia:
Daca valorile lui c
se exprima in g/l, e este denumit coeficient de extinctie
specifica, iar daca c se exprima in ioni-gram/l sau moli/l, e se
numeste coeficient de extinctie molara sau absorbanta
molara.
In practica
analitica se determina densitatea optica la o anumita
lungime de unda pentru o solutie care contine 1 g de substanta in
100 ml solutie, intr-un strat de solutie cu grisimea de 1 cm. Aceasta poarta denumirea
de extinctie specifica E1 Cm1%.
|
|
E = extinctia citita la
o anumita lungime de unda;
c = concentratia;
l = grosimea stratului (cuvei).
|
Cunoscind extinctia
specifica se poate deduce concentratia unei solutii din formula:
In determinarile spectrofotometrice in
ultraviolet sau vizibil trebuie sa se cunoasca lungimea de unda
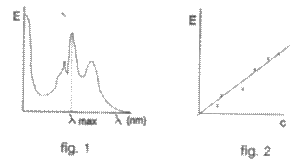
la care exista un maxim de absorbtie. Pentru aceasta se traseaza
spectrul de absorbtie a substantei respective, de o anumita
concentratie urmarind variatia densitatii optice (E)
in functie de lungimea de unda ( ), (fig.1), Lungimea de unda la care
absorbanta este maxima, se determina din grafic ( max Cunoscandu-se concentratia
solutiei, valoarea absorbtiei la si grosimea stratului absorbant
se poate calcula e coeficientul de extinctie molara
|
|
E = valoarea extinctiei la max
c = concentratia solutiei mol/l;
l =
grosimea stratului absorbant (cm)
|
In
vederea determinarilor spectrofotometrice (sau fotometrice) trebuie sa se cunoasca domeniul de
aplicabilitate a legii Lambert-Beer adica domeniul in care absorbanta (E) variaza liniar cu
concentratia (c) la o
lungime de unda la care absorbanta este maxima λmax ) (fig-2).
Aceasta lege este verificata daca se
utilizeaza o lumina monocromatica, solutiile nu sunt prea
concentrate, nu prezinta fluorescenta si nu sunt tulburi.
Reprezentarea grafica a valabilitati legii Lambert-Beer
reprezinta curba etalon, din care prin extrapolarea valorii
extinctiei probei necunoscute pe curba etalon se determina concentratia
necunoscuta. Concentratia
probei de analizat se poate determina si din relatia data
anterior cunoscand valoarea E, cm
(extinctia specifica).
DOZAREA
SPECTROFOTOMETRICA A CLORHIDRATULUI DE EFEDRINA
Ustensile
5
baloane cotate de 25 ml numerotate de la 1 la 5
1
balon cotat de 25 ml pentru proba simulata marcat cu PS
1
balon cotat de 25 ml pentru proba de ser efedrinat marcat cu SE
1
pahar Berzelius de 100 ml pentru apa distilata folosita pentru dilutii
1
pipeta gradata 5 ml + para cauciuc
1
pipeta de plastic pentru apa distilata
Solutii
solutie
stoc de clorhidrat de efedrina (concentratia marcata pe balonul cotat)
fiole
cu solutie injectabila de clorhidrat de efedrina 1% (m/v)
Mod de lucru
Solutiile de etalonare
Se
masoara din 0,5; 1; 2; 3 si respectiv 5 ml solutia (1) in baloanele cotate 1, 2, 3, 4 si
respectiv 5
Se
dilueaza la semn cu apa distilata
Proba simulata - PS
Se
masoara din solutia stoc de efedrina (1) 4 ml in balonul cotat PS
Se
dilueaza la semn cu apa distilata
Proba diluata de ser efedrinat - SE
100
µl solutie injectabila de clorhidrat de efedrina 1% (2) se dilueaza
cu apa pana la semn intr-un balon cotat de 100 ml. Din solutia
rezultata se masoara 2 ml in balonul cotat SE de 25 ml si
se aduce la semn cu apa distilata.
Se
determina valoarea absorbantei solutiei SE la lungimea de
unda cu absorbanta maxima
Masuratorile spectrofotometrice
Se
porneste spectrofotometrul cu 15 minute inainte de efectuarea masuratorilor.
Intr-una
din cuvele de cuart se introduce apa distilata pana la 2/3 din capacitate si
peretii cuvei se sterg de orice urma de lichid. Se verifica de asemenea LIPSA
bulelor de aer lipite pe peretele intern al cuvei. In cealalta cuva
se introduce una din solutiile de calibrare preparate (exemplu
solutia nr.3)
Cuvele
vor fi introduse in suportul de probe si se va inchide capacul.
Se
inregistreaza din 10 - 10 nm, pe domeniul 200 - 300 nm, valoarea
absorbantelor solutiei 3 eliminand de fiecare data
absorbanta solventului (blanc).
Pentru
a stabili mai exact lungimea de unda cu maxim de absorbanta se
vor citi valorile absorbantelor solutiei 3 (din 2 - 2 nm) pe un
domeniu spectral mai restrans (cca. 10nm) din jurul maximului
Dupa
alegerea lungimii de unda cu maxim de absorbanta se va determina
absorbanta celorlalte solutii de calibrare, precum si a
solutiilor PS si SE
Se
recomanda ca solutiile sa se citeasca succesiv in ordinea
crescanda a concentratiilor.
ATENTIE!
La schimbarea solutiilor din cuve, acestea se spala cu apa
distilata, dupa care se clatesc de trei ori cu mici
portiuni din solutia care urmeaza sa fie analizata!
Cuvele nu trebuie umplute mai mult de 2/3 din capacitate si inaintea
introducerii lor in spectrofotometru peretii cuvei se sterg de orice urma de
lichid. Se verifica de asemenea LIPSA bulelor de aer lipite pe peretele
intern al cuvei.
ATENTIE!
Cuvele de cuart se scot CU GRIJA din lacasele de citire, se golesc, se
spala cu apa distilata si se aseaza in cutia de pastrare!
Interpretarea rezultatelor
o
I.
Calcule pe baza legii Lambert-Beer
Determinati
lungimea de unda cu maximul
de absorbtie ( max)
al solutiei standard din balonul numarul 3 in nanometrii
λmax
= nm
Determinati valoarea absorbantei solutiei
standard din balonul 3 la λmax
 UA
UA
Calculati
concentratia molara cstd3 a solutiei standard din balonul 3. Masa moleculara
a clorhidratului de efedrina este 201.7 g/mol.
cstd = mol/l
Conform
legii Lambert-Beer coeficientul molar de extinctie ελmax se poate determina cunoscand valoarea 
ελmax
=  cstd · d)
cstd · d)
ελmax
= l/(mol·cm)
Determinati
valoarea absorbantei probei simulate-PS-(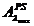 ) si a probei diluate de ser efedrinat (solutia 2) la max
) si a probei diluate de ser efedrinat (solutia 2) la max
 UA
UA
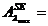 UA
UA
Cunoscand
coeficientul molar de extinctie max
si absorbanta probei simulate 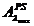 precum si cea a probei
de ser efedrinat diluate
precum si cea a probei
de ser efedrinat diluate  putem calcula
concentratia acestor solutii utilizand ecuatia legii Lambert-Beer:
putem calcula
concentratia acestor solutii utilizand ecuatia legii Lambert-Beer:
A c d
unde: = lungimea de unda [nm]
A = valoarea absorbantei [UA] la
= coeficientul molar de extinctie [l/(mol·cm] la
c = concentratia [mol/l]
d = drumul optic [cm]
cPS = 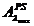 /( max
· d)
/( max
· d)
cPS = mol/l
In acelasi mod se calculeaza si concentratia probei de ser efedrinat
diluate (cSE).
o
II.
Calcule pe baza curbei de calibrare
Calculati
concentratiile molare ale celor cinci solutii standard preparate in baloanele
1-5.
|
cstd1 =
|
|
mol/l
|
|
cstd2 =
|
|
mol/l
|
|
cstd3 =
|
|
mol/l
|
|
cstd4 =
|
|
mol/l
|
|
cstd5 =
|
|
mol/l
|
Introduceti
in tabelul de mai jos valorile absorbantelor masurate pentru cele cinci solutii
standard.
|
Proba
|
Absorbanta [UA] la λmax
|
|
cstd1
|
|
|
cstd2
|
|
|
cstd3
|
|
|
cstd4
|
|
|
cstd5
|
|
Pe
o hirtie milimetrica se reprezinta punctele in sistemul de coordonate
absorbanta masurata = f
(concentratie) si trasati dreapta care considerati ca
aproximeaza cel mai bine punctele experimentale
Introduceti
datele obtinute intr-un tabel de forma
|
Balonul
|
X (mol/l)
|
Y
(UA)
|
X2
|
Y2
|
X·Y
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Suma
|
|
|
|
|
|
Calculati
ecuatia dreptei de calibrare y = a + b·x (unde "y" este absorbanta, "x"
este concentratia molara, "a" este ordonata la origine, iar "b" este panta
dreptei) conform formulelor:


Calculati
valoarea concentratiei probei simulate(PS) si a probei diluate de ser
efedrinat(SE) prin:
- Inlocuirea in ecuatia dreptei obtinuta
prin calcul
- Extrapolarea valori pe dreapta construita pe
hartie milimetrica
o
III.
Calcule pe baza 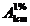
Cunoscand
valoarea absorbantei solutiei standard din balonul 3 la max  calculati valoarea
calculati valoarea 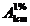 , stiind ca s-a lucrat cu o cuva de diametrul de 1cm:
, stiind ca s-a lucrat cu o cuva de diametrul de 1cm:
 .. cstd3 [%
m/v]
.. cstd3 [%
m/v]
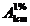 ..1% (m/v)
..1% (m/v)
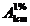 =
= 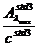
Cunoscand
 calculati concentratia
procentuala (m/v) a solutiei diluate de ser efedrinat.
calculati concentratia
procentuala (m/v) a solutiei diluate de ser efedrinat.
cSE = 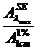 (% m/v)
(% m/v)
o
IV.
Calculul concentratiei solutiei de ser efedrinat
Cunoscand
concentratia probei de ser efedrinat diluata (cSE [mol/l]) si dilutia efectuata la
prepararea solutiei 2, calculati concentratia initiala a serului efedrinat (c%
m/v). Masa moleculara a clorhidratului de efedrina este 201,7 g/mol.
|
Concentratia
declarata ser efedrinat
|
Concentratia
determinata ser efedrinat
|
|
c = 1% m/v
|
c = % m/v - cu ajutorul max
|
|
c = % m/v - cu ajutorul dreptei de
calibrare
|
|
c = % m/v - cu ajutorul 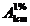
|
o
V.
Discutii
Ce
semnificatie are panta dreptei de calibrare?
Ce
relatie exista intre panta dreptei de calibrare si coeficientul molar de
extinctie ( max
Comparati
si comentati rezultatele obtinute fata de cele
teoretice.
Comparati
rezultatele obtinute intre ele.


