FENOMENE DE INTERFATA
Suprafata de
separare dintre doua faze, numita interfata,
are o structura proprie si proprietati specifice, diferite
de structura si proprietatile fazelor volumice. Fenomenele de interfata
sunt datorate fortelor intermoleculare si sunt cu atat mai intense cu
cat marimea suprafetei de
contact creste.
In functie de
starea de agregare a fazelor de contact se disting urmatoarele
interfete:
lichid-gaz (L-G)
lichid-lichid
(L-L)
lichid-solid
(L-S)
solid-gaz (S-G)
Fenomenele fizice ce apar la interfate sunt: tensiunea
superficiala, capilaritatea si adsorbtia.
1.
Tensiunea superficiala
1.1.Coeficientul
de tensiune superficiala
Se considera interfata lichid-gaz, suprafata libera
a lichidului aflat in repaus fiind plana si orizontala.
Asupra fiecarei
molecule din volumul lichidului actioneaza forte de
atractie moleculara de catre moleculele din jur, numite forte de coeziune, ele se
manifesta pe distante scurte de ordinul nanometrilor (10-9).
Spatiul in care actioneaza fortele de coeziune pentru o
molecula data se numeste sfera
de actiune moleculara, iar raza acestuia raza de actiune moleculara (r0). In sfera
de actiune moleculara se gasesc un numar foarte mare de molecule
(~ 105), care din punct de vedere statistic sunt distribuite uniform
in jurul moleculei considerate. Din aceasta cauza rezultanta
fortelor de coeziune dintre molecula considerata si cele din
sfera de actiune moleculara este nula.
Sfera de activitate
moleculara pentru o molecula situata in partea superioara a
paturii superficiale, care reprezinta stratul de lichid de la
interfata de grosime egala cu raza de actiune
moleculara, cuprinde molecule de lichid, dar si un numar mai mic
de molecule de gaz, densitatea gazului fiind mai mica decat a lichidului.
Astfel, pe de o parte
intre molecula considerata si cele de lichid actioneaza
forte de coeziune, a caror rezultanta ( ) este indreptata vertical spre interiorul lichidului.
Pe de alta parte, intre molecula din stratul superficial si cele de
gaz actioneaza forte de adeziune mai slabe, rezultatnta lor (
) este indreptata vertical spre interiorul lichidului.
Pe de alta parte, intre molecula din stratul superficial si cele de
gaz actioneaza forte de adeziune mai slabe, rezultatnta lor ( ) fiind orientata vertical in sus si mult mai
mica decat cea a fortelor de coeziune. Rezultanta finala (
) fiind orientata vertical in sus si mult mai
mica decat cea a fortelor de coeziune. Rezultanta finala (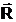 ), al carui modul este egal cu R = RC - RA
, va fi orintata spre interiorul lichidului, perpendicular pe
suprafata acestuia (Fig.1).
), al carui modul este egal cu R = RC - RA
, va fi orintata spre interiorul lichidului, perpendicular pe
suprafata acestuia (Fig.1).

Fig.1. Fortele ce actioneaza asupra moleculelor
unui lichid.
Asupra tuturor moleculelor de lichid aflate la suprafata
actioneaza aceasta rezultanta 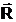 , ceea ce determina ca stratul superficial sa
exercite o presiune asupra restului lichidului, numita presiune
moleculara (pmol). Ea este foarte mare, de ordinul 104
atm, si sub actiunea ei moleculele lichidului se aproprie foarte mult
unele de altele, aceasta fiind cauza incompresibilitatii lichidelor
in stare normala. De asemenea si motivul pentru care moleculele din
stratul superficial au tendinta de a intra in volumul lichidului, micsorandu-i
suprafata libera.
, ceea ce determina ca stratul superficial sa
exercite o presiune asupra restului lichidului, numita presiune
moleculara (pmol). Ea este foarte mare, de ordinul 104
atm, si sub actiunea ei moleculele lichidului se aproprie foarte mult
unele de altele, aceasta fiind cauza incompresibilitatii lichidelor
in stare normala. De asemenea si motivul pentru care moleculele din
stratul superficial au tendinta de a intra in volumul lichidului, micsorandu-i
suprafata libera.

Fig.2. Forte de tensiune superficiala.
Intre moleculele
stratului superficial se exercita de asemenea forte de coeziune, care
se anihileaza reciproc, cu exceptia celor din vecinatatea
peretilor vasului, numite forte de tensiune superficiala (F). Ele actioneaza tangential la suprafata
libera, fiind distribuite uniform pe lungimea conturului si
perpendicular pe acesta (Fig.2.).
Fortele de
tensiune superficiala au tendinta de a micsora aria
suprafetei libere a lichidului, pana la o valoare minima, care
sa corespunda unei energii potentiale minime, deci unei
stabilitati a stratului superficial.
Forta de tensiune
superficiala depinde numai de natura lichidului si de lungimea
conturului stratului superficial (l):
F = s l (1)
unde s este coeficient de tensiune superficiala, fiind o marime
specifica fiecarui lichid in parte. In SI coeficientul de tensiune
superficiala se masoara in N/m.
Deplasarea unei molecule inspre si dinspre patura
superficiala presupune efectuarea unui lucru mecanic (L), corelat cu
variatia suprafetei stratului superficial (DS), respectiv cu variatia energiei potentiale (DEp):
DEp = - L = s DS (2)
de unde
s DEp / DS (3) Deci, coeficientul de tensiune superficiala
reprezinta lucrul mecanic efectuat impotriva fortelor de tensiune
superficiala, pentru marirea suprafetei libere a lichidului cu o
unitate.
Studii asupra
coeficientului de tensiune superficiala au aratat ca depinde de
natura fazelor aflate in contact si
scade cu cresterea temperaturii, deoarece prin cresterea
agitatiei termice fortele intermoleculare scad. Se anuleaza la
temperatura critica, atunci cand are loc transformarea de faza
lichid-gaz.
In Tabelul 1. sunt
prezentate valori ale coeficientului de tensiune superficiala si ale
presiunii moleculare pentru unele lichide la diferite temperaturi, la
interfata lichid-aer.
Tabel 1. Coeficient de tensiune
superficiala si presiuni moleculare ale unor lichide
|
Lichid
|
t (0C)
|
s (mN/m)
|
pmol (atm)
|
|
apa
alcool etilic
glicerina
mercur
ser sangvin
urina
|
|
|
|
Stratul superficial, avand tendinta de a-si
micsora suprafata, se comporta ca o membrana elastica
tensionata, care spre deosebire de membrana elastica
propriu-zisa, are aceeasi tensiune in orice punct. In acelasi
timp, suprafata lichidului se comporta ca un rigid la impactul cu
alte corpuri, datorita comprimarii ei de catre stratul
superficial.
1.2.
Substante tensioactive
Tensiunea superficiala a solutiilor depinde de
natura solventului si solvitului, precum si de concentratia
solvitului. Apa, solventul general din organismele vii, este unul din lichidele
cu cel mai mare coeficient de tensiune superficiala (vezi Tabelul 1.),
ceea ce are o deosebita importanta in desfasurarea
proceselor biologice.
Notand cu s coeficientul de tensiune
superficiala al solventului pur si cu s pe cel al solutiei se poate urmari
influenta solvitului asupra tensiunii superficiale a solventului. Sunt
posibile urmatoarele trei situatii:
a)
s s - tensiunea superficiala a solventului pur ramane
constanta, deoarece solvitul nu modifica fortele intermoleculare
prin intercalarea lui in reteaua de punti de hidrogen ale apei
(exemplu: solutii apoase de zahar)
b)
> s - tensiunea superficiala a solutiei creste usor,
situatie intalnita in cazul solutiilor de electrolit. Unde, pe
de o parte exista interactiuni puternice intre ionii si dipolii
apei, determinand o crestere a fortelor moleculare din lichid,
respectiv o marire a tensiunii superficiale. Pe de alta parte, ionii
din stratul superficial sunt atrasi spre interiorul volumului de lichid
tot de legaturile polare, astfel incat concentratia lor in stratul
superficial este destul de redusa. Din acest motiv cresterea
tensiunii superficiale va fi foarte mica.
c)
s < s - tensiunea
superficiala a solutiei scade, fiind cazul solutiilor apoase de
substante organice polare. Substantele care determina
micsorarea coeficientului de tensiune superficiala se numesc substante tensioactive sau agenti tensioactivi.
Tensioactivitatea este o consecinta a structurii
atat a solventului cat si a solvitului.
1.3. Importanta tensiunii
superficiale pentru sistemele biologice
In general,
coeficientul de tensiune superficiala al lichidelor biologice este mai mic
decat al apei, ceea ce demonstreaza ca moleculele de interes biologic
sunt substante tensioactive.
In
organismele animale axista doua categorii de agenti
tensioactivi:
molecule care actioneaza in
mod secundar ca substante tensioactive, cum sunt majoritatea
catabolitilor ajunsi in stadiul de acizi organici, care sunt
tensioactivi. Exemplu lipidele si glucidele metabolizate la
stadiul de cataboliti acizi.
substante ce au ca rol principal
scaderea tensiunii superficiale. Din aceasta categorie fac parte acizii
biliari: glicocolic si taurocolic, care formeaza saruri solubile
in apa cu metalele alcaline. Sarurile acizilor biliari sunt
agenti tensioactivi foarte puternici, ele ataca bolul alimentar din
duoden prin scaderea tensiunii superficiale a grasimilor alimentare,
ducand la emulsionarea lor si usurand astfel actiunea lipazei
pancreatice.
Substantele
tensioactive in organism produc scaderea tensiunii superficiale si
prin aceasta conditioneaza procesele de permeabilitate ale
membranelor biologice, astfel favorizeaza permeabilitatea si
resorbtia intestinala.
Agentii
tensioactivi sunt utilizati ca adjuvanti in industria
farmaceutica, mizandu-se tocmai pe cresterea
permeabilitatii membranare. Anestezicele, deoarece
micsoreaza coeficientul de tensiunea superficiala a sangelui,
sunt substante tensioactive.
Tensiunea
superficiala conditioneaza forma celulelor circulante (celule
libere), care in general este sferica, suprafetele membranelor
celulare avand arie minima. Astfel, daca celula nu prezinta endoschelet membrana ia forma sferica, ceea ce
corespunde unei energii potentiale superficiale minime. Desigur, celula
poate avea si o alta forma, insa mentinerea ei se face
cu cheltuiala suplimentara de energie metabolica.
Proprietatile
amiboidale ale unor celule implica modificari locale ale tensiunii
superficiale, modificari realizate prin activarea unor enzime
proteolitice.
Unele insecte (Hydrometa, Halobater etc) folosesc
pentru locomotie proprietatile elestice ale stratului
superficial de apa. Aceste insecte prezinta adaptari specifice,
de exemplu sunt foarte usoare si extremitatile membrelor
sunt unse cu grasimi hidrofobe, care impiedica udarea lor.
Gasteropodul Aeolis secreta un
mucus pe care pluteste, mucus ce
are densitate mai mica decat apa, dar tensiune superficiala mai mare
decat a apei.
1.4. Interfata lichid-lichid
Tensiunea
interfaciala este o forma generalizata a
notiunii de tensiune superficiala, folosita pentru alte tipuri
de interfete (lichid-lichid, lichid-solid).
In cazul
contactului dintre doua lichide nemiscibile (apa-ulei,
apa-glicerina, apa-mercur, etc.) apare o tensiune
interfaciala mai mica decat tensiunea superficiala a
fiecarui lichid in parte.
In Tabelul 2. sunt
prezentate valori ale tensiunii interfaciale in cazul unor interfete lichid-apa.
Din tabel se poate constata ca tensiunile interfaciale scad cu cresterea temperaturii.
Tabel 2. Tensiunea interfaciala (sin) interfata
lichid-apa
|
Lichid
|
t
(0C)
|
sin
(mN/m)
|
|
Sulfura de carbon
|
|
|
|
Tetraclorura de carbon
|
|
|
|
Benzen
|
|
|
|
Nitrobenzen
|
|
|
|
Amilina
|
|
|
In functie
de tensiunea superficiala a lichidelor si tensiunea interfaciala
pot aparea doua cazuri distincte:
una din faze se separa de
cealalta sub forma de picaturi (exemple: picaturi de
glicerina in apa, grasimi topite pe apa fierbinte etc),
si
una din faze se intinde pe
suprafata apei formand, o pelicula monomoleculara, in care
gruparile hidrofile interactioneaza cu apa, iar cele hidrofobe
sunt indreptate spre exterior. De exemplu pot exista straturi monoproteice la
suprafata celulei sau la contactul dintre plasma si peretii
vaselor.
2. Fenomene capilare
2.1. Interfata solid - lichid
Fenomenele
superficiale au loc si la contactul dintre solid si lichid. In acest
caz trebuie sa se tina cont atat de fortele de coeziune FC
dintre moleculele lichidului, cat si de fortele de adeziune FA
dintre moleculele solidului si ale lichidului. Aceste forte au un rol
important in forma suprafetelor libere a lichidelor in regiunea de contact
cu solidul.
Suprafata
libera a lichidului dintr-un vas cu sectiune mare poate fi
plana, cand rezultanta 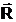 a fortelor de
coeziune si adeziune este indreptata in lungul peretelui vasului, sau
sub forma de menisc. Meniscul este concav cand
a fortelor de
coeziune si adeziune este indreptata in lungul peretelui vasului, sau
sub forma de menisc. Meniscul este concav cand 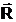 este orientata
spre exteriorul vasului, in acest caz lichidul uda solidul. Daca
este orientata
spre exteriorul vasului, in acest caz lichidul uda solidul. Daca 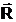 este indreptata
spre interior, meniscul este convex si lichidul nu uda solidul.
Rezultanta este perpendiculara pe tangenta dusa la suprafata
libera in unghiul de racord q. Suprafata de la mijlocul
vasului este orizontala, deoarece in aceasta zona
actioneaza numai fortele de coeziune.
este indreptata
spre interior, meniscul este convex si lichidul nu uda solidul.
Rezultanta este perpendiculara pe tangenta dusa la suprafata
libera in unghiul de racord q. Suprafata de la mijlocul
vasului este orizontala, deoarece in aceasta zona
actioneaza numai fortele de coeziune.
Un solid in
raport cu lichidele (Fig.3) poate fi:
a) solid liofil (hidrofil in cazul apei) cand  >
> 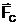 si 0 < q < p/2, menisc
concav, fiind udat de lichid;
si 0 < q < p/2, menisc
concav, fiind udat de lichid;
b) solid indiferent cu q p/2,
suprafata libera a lichidului fiind orizontala;
c) solid liofob (hidrofob) cand  <
< 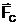 , p < q < p/2, menisc
convex, lichidul nu uda solidul.
, p < q < p/2, menisc
convex, lichidul nu uda solidul.

Fig.3 Forma suprafetelor libere a lichidelor la
contactul cu diferite solide: a) menisc concav (solid liofil); b)
suprafata orizontala (solid indiferent); c) menisc convex (solid
liofob).
2.2. Capilaritatea
Consideratiile
prevazute in paragraful anterior se regasesc si in cazul
tuburilor cu diametre mici (10-6 < d <10-3), numite tuburi capilare.
Cu ajutorul lor se pune in evidenta fenomenul cunoscut sub numele de
capilaritate, care consta in urcarea sau coborarea lichidului in tub
in raport cu nivelul lichidului din vas.
In cazul
suprafetelor curbe din tuburile capilare, fortele de tensiune
superficiala, care actioneaza tangent in fiecare punct al meniscului,
au o componenta indreptata in lungul tubului. Rezultanta acestor
componente se numeste forta
Laplace si este orientata spre exteriorul lichidului pentru
meniscul concav, respectiv spre interior in cazul meniscului convex (Fig.4.).
Forta Laplace va determina aparitia unei presiuni suplimentare
capilare, ps, de forma:
ps
= 2s / r (4)
unde r este raza capilarului.
Deci,
sub actiunea fortelor de tensiune superficiala la nivelul
meniscului are loc un salt de presiune Dp, expresia pentru meniscul ideal fiind:
Dp = pext - pint = 2s / r
(5)

Fig. 4. Forta Laplace; a) menisc concav
si b) menisc convex.
Datorita
acestui salt presiunea de-a lungul capilarului variaza astfel: sub
meniscul concav este p0 - 2s/r, deci mai mica decat presiunea
atmosferica (p0), si creste spre baza tubului capilar
ajungand la nivelul lichidului din vas egala cu p0. Deci, in
tot capilarul presiunea este mai mica decat cea atmosferica, si
lichidul urca in tub. In cazul lichidului care nu uda peretii
capilarului, fenomenele se petrec invers, are loc o depresiune capilara,
respectiv o scadere a presiunii in tubul capilar de la valoarea p0
+ 2s/r la nivelul meniscului convex pana la p0, la baza tubului
capilar.
In
cazul lichidelor reale, in expresia presiunii suplimentare trebuie sa se
tina cont si de contributia unghiului de racord dintre
suprafata libera si peretii tubului.
Ascensiunea
pentru tuburile capilare liofile si depresiunea capilara pentru
tuburile capilare liofobe este data de legea
lui Jurin:
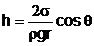 (6)
(6)
unde s - coeficientul de tensiune
superficiala, r - densitatea lichidului, g - acceleratia
gravitationala, r - raza capilarului si q -unghiul de racord.
Capilaritatea
este un fenomen foarte des intalnit in lumea vie, dar este produs si pe
cale artificiala. Astfel, sta la baza ascensiunii sevei in tulpinile
si frunzele plantelor, contribuie la circulatia sangvina in
capilarele organismelor vii, la mentinerea umiditatii solului.
Utilizarea hartiei de filtru, a buretelui si vopsirea fibrelor se
bazeaza tot pe fenomene capilare.
3. Adsorbtia
La
nivelul interfetelor dintre doua faze pot aparea modificari
de concentratie ale substantelor aflate in contact. Astfel,
substantele liofobe se aglomereaza la suprafata lichidului,
concentratia superficiala fiind mult mai mare decat cea din volumul
de lichid, determinand scaderea tensiunii superficiale. Deci, apare o
repartitie inegala a substantelor intre fazele sistemului
heterogen.
Adsorbtia este fenomenul de
acumulare si fixare a moleculelor unei substante pe suprafata
unui suport lichid sau solid. Faza care retine moleculele se numeste adsorbant, iar substanta care se
fixeaza se numeste adsorbit.
Observatie Adsorbtia este un fenomen de
suprafata, spre deoserbire de absorbtie care este un fenomen de
volum.
Fenomenul de adsorbtia se poate
clasifica dupa mai multe criterii.
Din punct de vedere al interfetelor
exista:
adsorbtie gaz-lichid;
adsorbtie gaz-solid
adsorbtie lichid-lichid;
adsorbtie lichid-solid.
Pentru biologie, importanta
deosebita prezinta ultimele doua interfete.
2. In functie de tipul de interactiune de la suprafata de
separare:
adsorbtie fizica - permite formarea pe suprafata
adsorbantului a unui strat, de regula monoatomic, sub actiunea
fortelor van der Waals.
adsorbtie chimica
(chemisorbtie) -
adsorbantul formeaza un complex molecular nou cu adsorbitul prin diferite
tipuri de legaturi chimice.
3. In functie de marimea
fortelor dintre moleculelor adsorbantului, F0 , si a fortelor dintre moleculele de
adsorbant si adsorbit, F,:
adsorbtie pozitiva -
cand F0 > F, atunci moleculele adsorbitului sunt " impinse"
spre patura superficiala, unde creste concentratia lor.
Acest tip de adsorbtie se intalneste la substantele
tensioactive.
adsorbtie negativa -
cand F0 < F, atunci moleculele adsorbitului se
acumuleaza in volumul lichidului, si de fapt, practic este
absorbtie. Se intalneste la solutiile de electrolit.
Adsorbtia
este un proces in mare masura reversibil, fenomenul invers se
numeste desorbtie. Cele
doua procese au un anumit grad de selectivitate si, din acest motiv,
au o larga aplicabilitate in cromatografie, pentru separarea prin
elutie a componentelor unui amestec fixat pe un suport.





