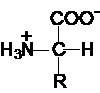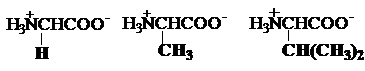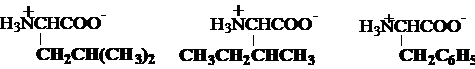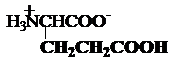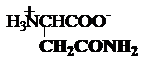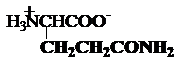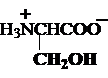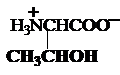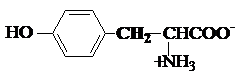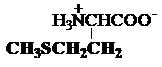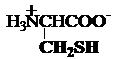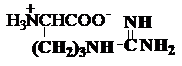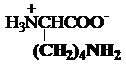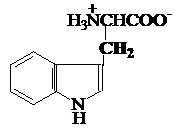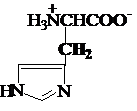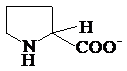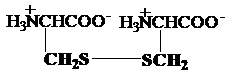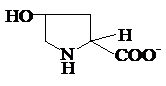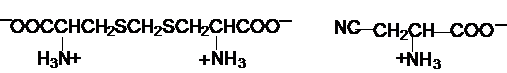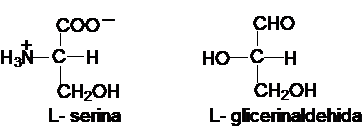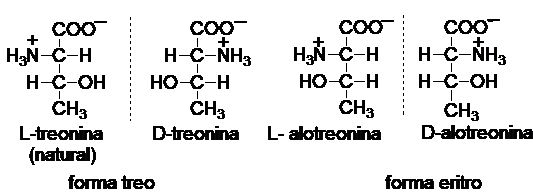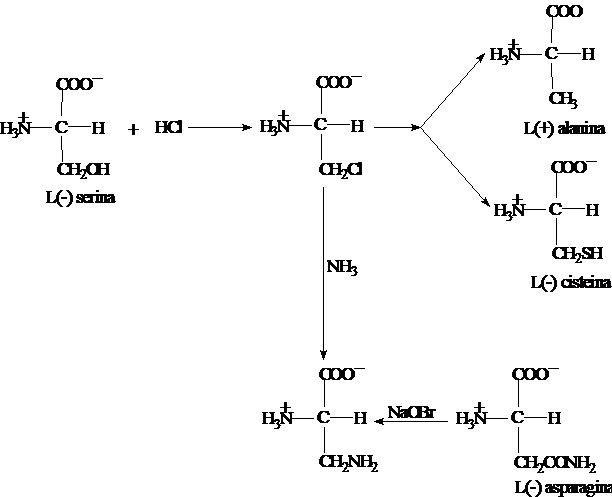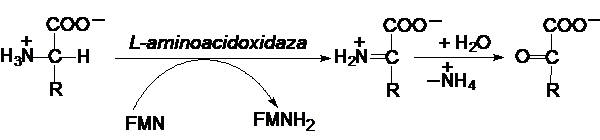AMINOACIZI NATURALI
Prin hidroliza proteinelor, in
conditii bine controlate, au fost obtinuti 20 de aminoacizi diferiti, numiti aminoacizi
naturali.
In
natura exista peste 150 de aminoacizi, dar proteinele sunt formate din numai 20
a-aminoacizi
(care fac parte din seria L).
Primul
aminoacid izolat dintr-un hidrolizat proteic a fost glicina (glicocolul)
(1820):
H3N+-CH2-COO-
Aminoacizii din proteine au
urmatoarea formula generala:
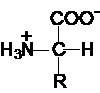
unde R este catena laterala.
1
.1.1 Clasificarea aminoacizilor
In functie de structura chimica,
aminoacizii se impart in sase grupe:
a) Aminoacizi monocarboxilici
glicina alanina valina
Gly, G Ala, A Val, V*
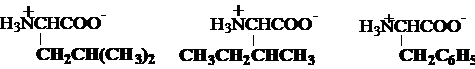
leucina izoleucina fenilalanina
Leu, L* Ile,I* Phe, F*
b) Aminoacizi
dicarboxilici
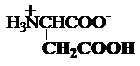
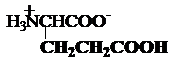
acidul asparagic sau
aspartic acidul glutamic
Asp, D Glu, E
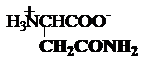
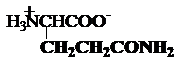
asparagina glutamina
Asn,
N Gln, Q
c) Hidroxiaminoacizi
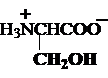
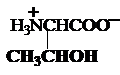
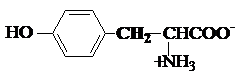
serina treonina tirozina
Ser, S Tre, T* Tyr, Y*
d) Tioaminoacizi
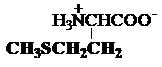
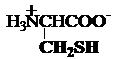
cisteina metionina
Cys,
C* Met, M*
e) Diaminoacizi
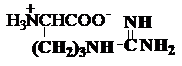
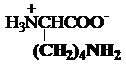
lizina arginina
Lys, K* Arg,
R
f) Aminoacizi
heterociclici
prolinahistidina triptofanul
Pro,P His, H* Trp, W*
In
celula vie prin modificari translationale, prolina si cisteina se
transforma in cistina si 4-hidroxiprolina:
cistina 4-hidroxiprolina
Cys -
S - S - CysHypro
Aminoacizii naturali care nu
pot fi sintetizati de organismul viu sunt notati cu asterisc "*"
si se numesc esentiali. Ei trebuie introdusi in organism prin
alimentatie.
In
afara de aminoacizii prezentati mai sus, in proteine mai exista si
alti aminoacizi: 5-hidroxi-lizina din colagen, desmozina din elastina,etc.
In
materia vie exista aminoacizi care nu sunt prezenti in proteine:
homoserina, homocisteina, ornitina, citrulina; D-alanina si acidul D-glutamic (in peretii
celulari bacterieni), acidul g-aminobutiric (neuro-transmitator), tiroxina (hormon
tiroidian), etc.
De
asemenea, sunt cunoscuti aminoacizi cu actiune toxica pentru formele
de viata: acidul djencolic si b-cianoalanina:
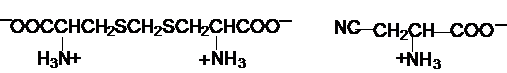
acidul djencolic b-cianoalanina
1.1.2 Proprietatile aminoacizilor naturali
3.1.2.1 Stereochimia aminoacizilor
naturali
Aminoacizii
din proteine sunt a-
aminoacizi si fac parte din seria L.
In afara de prolina si glicocol, ei au formula
generala:
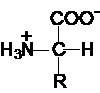
Pentru determinarea
stereochimiei unui aminoacid, termenul de referinta este L-serina, care
are configuratia S, conform configuratiei absolute CIP
(Cahn-Ingold-Prelog), asemanatoare cu configuratia L-glicerinaldehidei,
termenul de referinta pentru monozaharide:
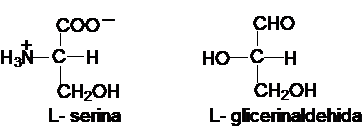
In seria aminoacizilor
incadrarea in seria D sau L se face considerand configuratia atomului de
carbon vecin grupei mai oxidate (carboxilul), in timp ce in seria
monozaharidelor se considera configuratia atomului de carbon cel
mai departat de gruparea oxidata (carbonil).
In cazul unui aminoacid cu doi
atomi de carbon chirali, exista doi racemici, deci patru stereoizomeri optici.
Exemplu: treonina: L- si D- treonina (forma treo),
L- si D-alotreonina (forma eritro):
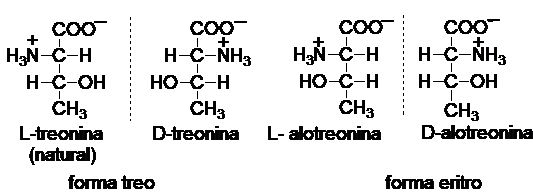
Determinarea
configuratiei aminoacizilor s-a facut prin reactii chimice
urmarindu-se inrudirea cu un compus sau aminoacid cu structura cunoscuta. In
Figura 3.1 se observa relatia intre L-serina si L-alanina, L-cisteina
si
L-asparagina:
Figura 3.1: Influenta reactiilor
chimice asupra activitatii optice
Ca si in cazul
monozaharidelor, nu toti aminoacizii din seria L deplaseaza planul
luminii
polarizate spre stanga (nu sunt levogiri).
Astfel
urmatorii aminoacizi: alanina, valina, izoleucina, acidul glutamic, glutamina,
arginina, lizina, izolati din proteine, sunt dextrogiri.
3.1.2.2 Starea de agregare
Aminoacizii
sunt compusi solizi, amfionici, cu puncte de topire foarte ridicate (peste
200oC).
3.1.2.3 Spectre de absorbtie
Aminoacizii
aromatici (tirozina, triptofanul, fenilalanina) absorb in ultraviolet la l = 280 nm.
Aceasta proprietate permite
dozarea continutului proteic al unei solutii.
3.1.2.4 Solubilitate
Aminoacizii
sunt compusi solubili in apa si in solventi polari.
Tirozina, fenilalanina si triptofanul sunt solubili
in solutie alcalina.
Proprietatile
aminoacizilor naturali sunt determinate de structura catenelor laterale R.
In functie de comportarea
fata de apa, aminoacizii sunt:
- hidrofobi (nepolari) - cu
catene R hidrofobe: alanina, valina, leucina, izoleucina,
metionina, triptofanul, fenilalanina, prolina, cisteina, glicina;
- hidrofili (polari)
- cu
catene R neutre : asparagina, glutamina, serina, treonina,
tirozina;
- cu
catene R bazice ( incarcate pozitiv la pH = 7) lizina, arginina, histidina;
- cu
catene R acide ( incarcate negativ la pH = 7) acidul aspartic (asparagic), acidul
glutamic.
In
solutii apoase neutre, aminoacizii prezinta momente de dipol mari datorita
existentei amfionului:
NH3
- CHR- COO -
In
solutie puternic acida, aminoacizii se gasesc sub forma de cation:
NH3
- CHR - COOH
In
solutie puternic bazica se afla sub forma de anion:
NH2 - CHR - COO-
3.1.2.5 Punctul izoelectric
Exista
o valoare a pH-ului, numita punct izoelectric, (pI), la
care concentratia formei cationice este egala cu cea a formei anionice,
forma amfionica fiind predominanta.
La punctul izoelectric solubilitatea
aminoacidului este minima, iar migrarea ionilor in cursul electrolizei unei
solutii apoase de aminoacid inceteaza.
Cationul
unui aminoacid, conform teoriei Brönsted, este un acid bibazic si prezinta
doua trepte de ionizare:
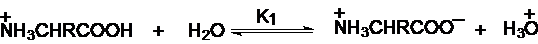
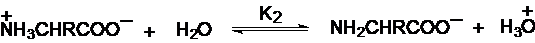
Expresiile
pentru cele doua constante de aciditate se pot scrie, conform legii maselor,
considerand solutia suficient de diluata pentru a inlocui
activitatile cu concentratiile speciilor ionice. Variatia
concentratiei apei este neglijata:
[+NH3
CHR COO- ] [H3O+] [NH2
CHR COO- ] [H3O+]
Ka1 =
-------- ----- ------ -- ; Ka2 =
-------- ----- ------
[+NH3
CHR COOH] [+NH3 CHR
COO- ]
Prin logaritmare si inlocuind: - log[H3O+]
= pH, - log Ka1= pKa1,
-log Ka2 = pKa2 ,
se obtine :
[+NH3 CHR COO- ]
pKa1 = pH -
log ----- ----- --------- ----- ----
[+NH3
CHR COOH]
[NH2
CHR COO- ]
pKa2 = pH -
log ----- ----- ---------------
[+NH3
CHR COO- ]
Daca
se titreaza o solutie acida a unui aminoacid cu hidroxid de sodiu pana la
semineutralizare (primul punct de echivalenta, pH = pKa1)
cand jumatate din forma cationica a fost transformata in cea amfionica:
[+NH3CHRCOOH] = [+NH3CHRCOO-
]
Cu
exces de baza restul formei cationice este transformat in forma amfionica (pI),
apoi se atinge al doilea punct de echivalenta, cand jumatate din forma
amfionica este transformata in forma anionica ( pH = pKa2)
si prin continuarea titrarii restul formei amfionice este transformata
total in forma anionica.
Expresia
punctului izoelectric pentru aminoacizii monocarboxilici si monabazici se
poate determina din expresiile pKa-urilor:
[+NH3 CHR COO- ]
[H3O+]
[+NH3 CHR COOH] = -------- ----- ------ --
Ka1
[+NH3 - CHR- COO- ]
Ka2
[NH2 CHR COO- ] = ----- ----- --------- ----- -------
[H3O+]
Se
egaleaza cele doua expresii (conditia punctului izoelectric) si
se obtine:
[H3O+]2
= Ka1 Ka2 de unde rezulta [H3O+] = (Ka1
Ka2)1/2
Dupa logaritmare si inmultire cu (-1) se
obtine:
pI
= 1/2 ( pKa1 + pKa2)
In Tabelul 3.1 sunt prezentate
valori pKa si pI pentru cativa aminoacizi
naturali:
Tabelul
3.1: Valori pKa si pI ale unor aminoacizi
Aminoacid
|
pKa1
a-COOH)
|
pKa2
a- +NH3)
|
pKa3
(catena laterala,R)
|
pI
|
glicocol
|
2,35
|
9,78
|
|
6,1
|
|
alanina
|
2,35
|
9,87
|
|
6,1
|
|
leucina
|
2,33
|
9,74
|
|
6,0
|
|
triptofan
|
2,46
|
9,48
|
|
5,9
|
|
acid aspartic
|
1,99
|
9,90
|
3,9 (COOH)
|
3
|
|
tirozina
|
2,20
|
9,21
|
10,46 (OH)
|
5,7
|
|
arginina
|
1,82
|
8,99
|
12,48 (guanidina)
|
10,8
|
|
lizina
|
2,16
|
9,06
|
10,5 (+NH3)
|
9,7
|
|
histidina
|
1,80
|
9,33
|
6,04
(imidazol)
|
7,6
|
Valorile din tabelul de mai sus permit calculul
raportului
[acceptor de protoni] / [donor de protoni] din legea
Henderson- Hasselbalch.
Analizand Tabelul 3.1 se constata ca:
-
grupa a-COOH
este un acid mai puternic decat acizii alifatici corespunzatori (acidul acetic
are pKa = 4,6); acest fapt se datoreste prezentei
grupei amino protonate din pozitia a
-
grupa a-+NH3
este un acid tare (baza slaba) in raport cu grupele amino din aminele alifatice
corespunzatoare;
-
aminoacizii naturali nu au capacitate de tamponare in jurul pH-ului fiziologic
(pH = 7) cu exceptia histidinei;
-
grupele SH si OH sunt foarte slab acide;
-
grupa amino din pozitia e din lizina este baza puternic.
O
metoda de dozare a aminoacizilor des utilizata este titrarea cu solutie de
NaOH a unei solutii de aminoacid in care s-a adaugat formol 40%
(solutie de formaldehida in apa).
Formaldehida in exces se combina usor cu grupele
amino libere din aminoacid, iar protonii eliberati se titreaza cu
solutie de NaOH pana la
pH = 8 (viraj fenolftaleina):
 NH3
CHR COO- + 2 CH2O
+ H2O (HOCH2)2NCHRCOO-
+ H3O+
NH3
CHR COO- + 2 CH2O
+ H2O (HOCH2)2NCHRCOO-
+ H3O+
Aminele tertiare formate
sunt baze mai slabe decat cele primare, au pK mai jos si aminoacizii pot
fi neutralizati cu baza la pH mai scazut (pH = 8) fata de cazul cand
nu se introduce formaldehida (pH = 11-12).
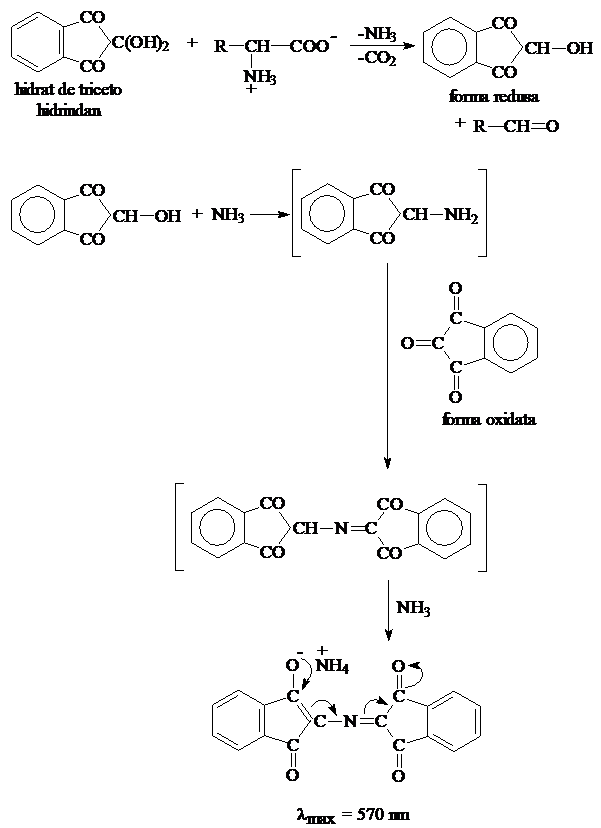
Reactia
de recunoastere a aminoacizilor
Aminoacizii
reactioneaza cu ninhidrina ( hidrat de tricetohidrindan) cu formarea
unui compus colorat albastru-violet, cu exceptia prolinei si
hidroxi-prolinei, care formeaza un compus galben.
O schema de mecanism pentru
aceasta reactie este prezentata in Figura 3.4 (pag.39).
3.1.2.7 Reactia de dozare a
aminoacizilor
Aminoacizii
reactioneaza cu acid azotos si pun in libertate azot molecular, care
se masoara volumetric, putandu-se determina cantitatea de aminoacid care a
reactionat.
Cu aceasta metoda se dozeaza
grupele amino libere din peptide sau proteine (metoda van Slyke):

3.1.2.8 Reactiile
biochimice ale aminoacizilor
Transformarile biochimice ale aminoacizilor vor fi
detaliate in partea a doua a cursului (Catabolismul aminoacizilor):
a)Decarboxilarea
Prin
decarboxilare aminoacizii formeaza amine biogene caracterizate prin
actiune biologica foarte
importanta:
Exemplu: - histamina, se formeaza prin decarboxilarea
histidinei (stimuleaza secretia gastrica, este vasodilatator si
regleaza tonusul muscular) si este implicata in reactiile alergice
ale organismului.
- putresceina si cadaverina,
formate prin decarboxilarea ornitinei si lizinei, sunt toxice.
purpura lui Ruhemann
Figura 3.4: Mecanism
propus pentru reactia de recunoastere a
aminoacizilor cu ninhidrina
b)
Transaminarea
Transaminarea
este reactia de transfer a grupei amino de la un aminoacid la un a-cetoacid in
prezenta unei aminotransferaze conform urmatoarei ecuatii globale:
 a-aminoacid1
+ a-cetoacid2 a-cetoacid1 +
a-aminoacid2
a-aminoacid1
+ a-cetoacid2 a-cetoacid1 +
a-aminoacid2
Prin
transaminare se biosintetizeaza aminoacizi specifici fiecarei celule vii in
concentratia necesara si la momentul adecvat.
c) Dezaminarea oxidativa aminoacizilor conduce la a-cetoacizi si
amoniac. Exista aminoacidoxidaze
specifice atat pentru L- aminoacizi, cat si pentru D-aminoacizi:
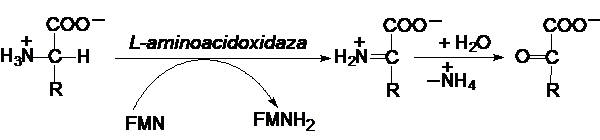
unde
FMN este flavinmononucleotida (vezi Vitamine si coenzime, Partea a II-a).
3.1.2.9 Analiza amestecurilor de
aminoacizi
Hidrolizatele proteice acide
contin aminoacizii componenti si se obtin prin incalzirea
unei solutii apoase de proteina (intr-o fiola de sticla inchisa) la 105oC,
in prezenta de HCl 6N, timp de 24 ore.
Desi prin hidroliza acida
se distruge triptofanul, iar glutamina si arginina sunt hidrolizate la
acizii corespunzatori, in practica se prefera acest tip de hidroliza deoarece
reactia in mediu bazic sau enzimatic prezinta mai multe inconveniente.
Amestecul de aminoacizi astfel
obtinut se poate analiza cu metode cromatografice:
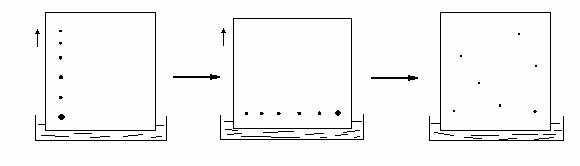
a) Cromatografia bidimensionala pe
hartie
Pe o hartie
de filtru se depune intr-un colt amestecul de aminoacizi
obtinut la hidroliza. Se developeaza cu
un solvent organic saturat cu apa realizand o cromatograma monodimensionala,
unde se observa o separare a aminoacizilor componenti. Dupa uscarea
hartiei se developeaza, in directie
perpendiculara
fata de prima, intr-un alt solvent. Astfel se obtine cromato-grama
bidimensionala:
Prin pulverizare cu o
solutie de ninhidrina se pune in evidenta locul fiecarui
aminoacid (pata albastru-violet).
Prin masurarea
spectrofotometrica a acestor pete se poate face determinarea cantitativa a
aminoacizilor componenti. Pentru o asemenea determinare sunt suficiente
0.2 - 0.4 g de proteina.
Un amestec de aminoacizi
obtinut prin hidroliza lanii a fost separat prin aceasta metoda utilizand
ca solventi colidina si apoi fenolul.
S-au
construit aparate automate de separare cromatografica a aminoacizilor, iar
dozarea acestora se face spectrofotometric.
b) Cromatografia prin schimb de ioni
Aceasta
metoda se bazeaza pe deosebirile proprietatilor acido-bazice ale
aminoacizilor si se pot separa amestecurile de aminoacizi in trei grupe:
* aminoacizi acizi,
retinuti pe rasini schimbatoare de anioni, care sunt
de obicei compusi poliaminati:
Rasina-NH3+OH- + RCOO- Rasina
NH3+ RCOO-
* aminoacizi bazici,
retinuti pe rasini schimbatoare de cationi (rasini
polisulfonate sau policarboxilice):
 Rasina-SO3- Na+ + RNH3+ Rasina-SO3- RNH3+
Rasina-SO3- Na+ + RNH3+ Rasina-SO3- RNH3+
* aminoacizi neutri, nu
sunt retinuti de rasini schimbatoare de ioni.
Astfel s-a reusit fractionarea completa a
amestecurilor de aminoacizi cu ajutorul polistirenului sulfonat la un pH
scazut, unde toti aminoacizii sunt sub forma de cationi, puternic
retinuti in partea superioara a coloanei.
Eluarea cu modificarea progresiva a pH-ului conduce la
izolarea aminoacizilor componenti care se desorb de pe coloana in
functie de capacitatea de ionizare.
c)
Cromatografia
in strat subtire
Este o metoda de separare prin cromatografia de lichide,
asemanatoare cu cromatografia pe hartie. In locul hartiei se folosesc
placi de sticla ( staniu sau material plastic) pe care este depus un
strat uniform de faza stationara: silicagel, alumina, etc.
Se depune un spot din solutia de aminoacizi care
urmeaza a fi separata si se developeaza cu un amestec de eluare
adecvat.
Aminoacizii vor migra mai repede sau mai incet in
functie de proprietatile acido-bazice care determina fixarea si
retinerea pe faza stationara.
d)
Cromatografia
in faza gazoasa
Este o metoda de separare completa a aminoacizilor dupa
ce au fost efectuate modificari structurale care sa-i faca volatili:
- metilarea
functiilor amino, fenolice sau alcoolice;
- esterificarea
grupelor carboxil.
Separarea
se face cu ajutorul unor coloane capilare ( cu diametrul 0.1 mm si peste 2
metri lungime), la temperaturi intre 100 - 200o C, utilizand faze
stationare lichide.
Aminoacizii se repartizeaza intre o faza stationara
lichida si o faza mobila gazoasa cu viteze diferite, care depind de
polaritatea lor.
Prin aceasta metoda se pot separa
cantitati foarte mici de aminoacizi (de ordinul picomolilor , 10-12
moli).
e) Cromatografia de adsorbtie
Aceasta metoda se bazeaza pe principiul adsorbtiei
de tip lichid-solid (cromatografie de lichide sub presiune) de inalta
rezolutie si de inalta performanta (HPLC).
f) Cromatografia de repartitie in contracurent
Aceasta metoda cromatografica
utilizeaza ca faza stationara amidon sau silicagel hidratat, iar faza
mobila este un lichid nemiscibil cu solventii in care se afla amestecul de
aminoacizi care urmeaza a fi separat.
Cu acest procedeu s-au separat
99% din aminoacizii rezultati la hidroliza albuminei din serul de bovine
si din lactoglobulina.